在核心產品停產、再注冊受挫的背景下,復星醫藥擬控股收購綠谷醫藥,引發市場高度關注。
交易尚未落地,上交所即下發監管工作函。
圍繞監管審批、產品前景與經營現實,這筆收購正被置于放大鏡下審視。
01
控股收購案被關注
昨日傍晚,商業大佬郭廣昌實控的復星醫藥(600196.SH,02196.HK)發布了一則對外投資公告。

投資人為復星醫藥控股子公司復星醫藥產業發展有限公司(下稱“復星醫藥產業”),被投資對象為綠谷(上海)醫藥科技有限公司(下稱“綠谷醫藥”)。
根據公告,復星醫藥產業擬合計出資約14.12億元取得綠谷醫藥控制權。
其中,1.43億元用于受讓創始人呂松濤控制的兩家企業所持綠谷醫藥2015萬元注冊資本,約12.69億元用于認繳新增注冊資本。
為配合綠谷醫藥存續的股權激勵計劃及員工退股安排,交易還將引入由復星醫藥產業與呂松濤或其關聯方共同設立的SPV。
相關退股成本由綠谷醫藥先行墊付,后續通過注冊資本轉讓及轉讓價格安排在復星醫藥與呂松濤之間分攤。
本次收購完成后,復星醫藥將通過復星醫藥產業及SPV合計持有綠谷醫藥53%股權,綠谷醫藥納入合并報表。
若后續呂松濤受讓復星醫藥產業所持SPV股權,則復星醫藥間接持有綠谷醫藥51%的股權,其依然并表。
值得注意的是,公告明確了重要的時間節點:
若未能在2026年1月31日或另行約定時間前完成交割,復星醫藥產業有權單方面終止交易,并將已取得的股權轉回原轉讓方或綠谷醫藥。
今天上午,上交所就該對外投資事項向復星醫藥下發監管工作函,具體內容未披露。
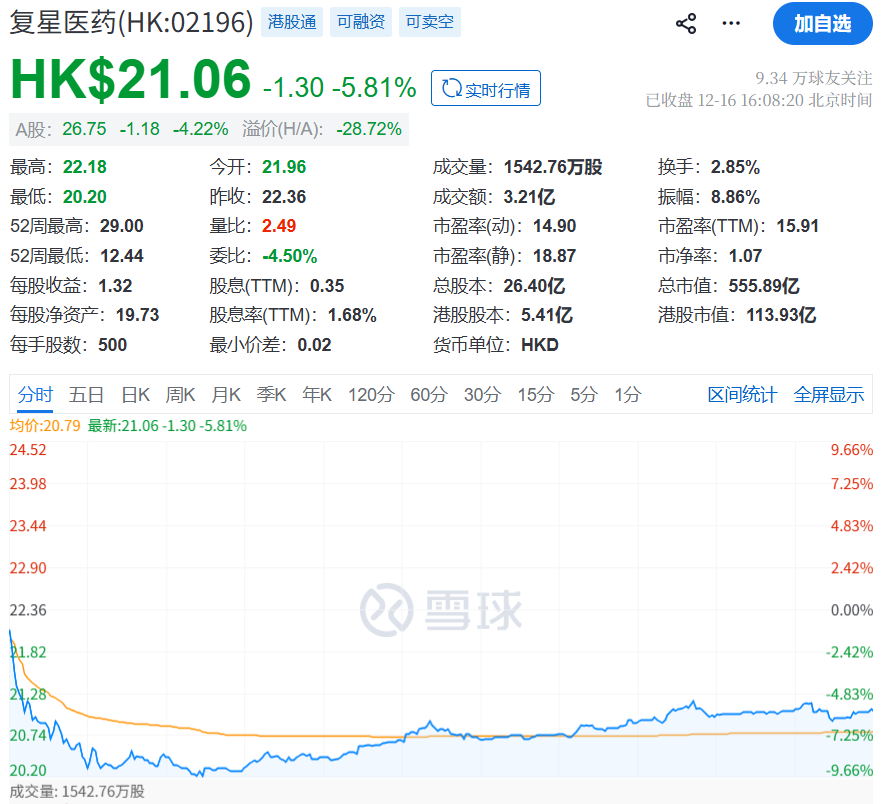
受此影響,復星醫藥A股、H股雙雙下跌。
截至下午,復星醫藥A股報收26.75元/股,下跌4.22%,總市值714.34億元。
復星醫藥港股一度大跌近10%,但截至收盤,其股價報21.06港元/股,下跌5.81%。
從披露信息看,復星醫藥并非“低價抄底”。
第三方評估顯示,截至2025年9月底,綠谷醫藥股東全部權益評估值為16.74億元。
在老股轉讓交易中,綠谷醫藥對應估值為16.50億元;而在新股認繳交易里,其對應的投前估值為14.69億元。
這一估值水平,在綠谷醫藥核心產品甘露特鈉膠囊斷供之際,可能成為監管與市場關注的焦點之一。
02
負債近8億元
成立于2018年10月的綠谷醫藥,業務高度集中于神經退行性疾病治療領域,其核心產品為甘露特鈉膠囊(商品名:九期一,代號:GV-971))。

該藥2019年11月獲國家藥監局有條件批準上市,2021年進入國家醫保目錄,上市初期迅速放量,成為國內阿爾茨海默病治療領域的“明星藥物”。
2021年12月,綠谷醫藥在一份新聞稿中表示,納入醫保目錄后,該藥價格由原來的每盒895元降至296元,降幅超60%。
但高度依賴單一產品的模式,也使公司在監管節點面前承壓明顯。
由于未能在規定期限內完成上市后確證性臨床試驗,甘露特鈉膠囊的有條件批準注冊于2024年11月到期。
自此,甘露特鈉膠囊停止生產,在庫存消化完畢后停止銷售,直接導致綠谷醫藥收入斷崖式下滑。
財務數據清晰反映了這一變化。經審計,2024年綠谷醫藥實現營收約5.72億元,凈利潤7077萬元。
而2025年前三季度,營收僅約1.02億元,凈利潤轉為虧損6761萬元。
截至今年9月底,公司總資產約為8.06億元,負債總額為7.95億元,所有者權益為1036萬元。
停產帶來的不僅是財務壓力,也迅速傳導至組織層面。
6月份,綠谷醫藥被曝關閉甘露特鈉膠囊業務相關辦公區和生產區。
7月中旬,有消息稱該公司內部會議宣布全國銷售工作將于當月底終止,僅保留少量人員繼續支持臨床即時檢驗(PoCT)。
此舉意味著,在綠谷醫藥原有上千名員工中,近八成面臨裁員。
這一輪停工、裁員,使綠谷醫藥的持續經營能力問題進一步凸顯。
合規層面,綠谷醫藥亦留下瑕疵。
10月份,因涉嫌在甘露特鈉膠囊推廣中進行商業賄賂行為,綠谷醫藥被上海市浦東新區市場監管局罰款40萬元。
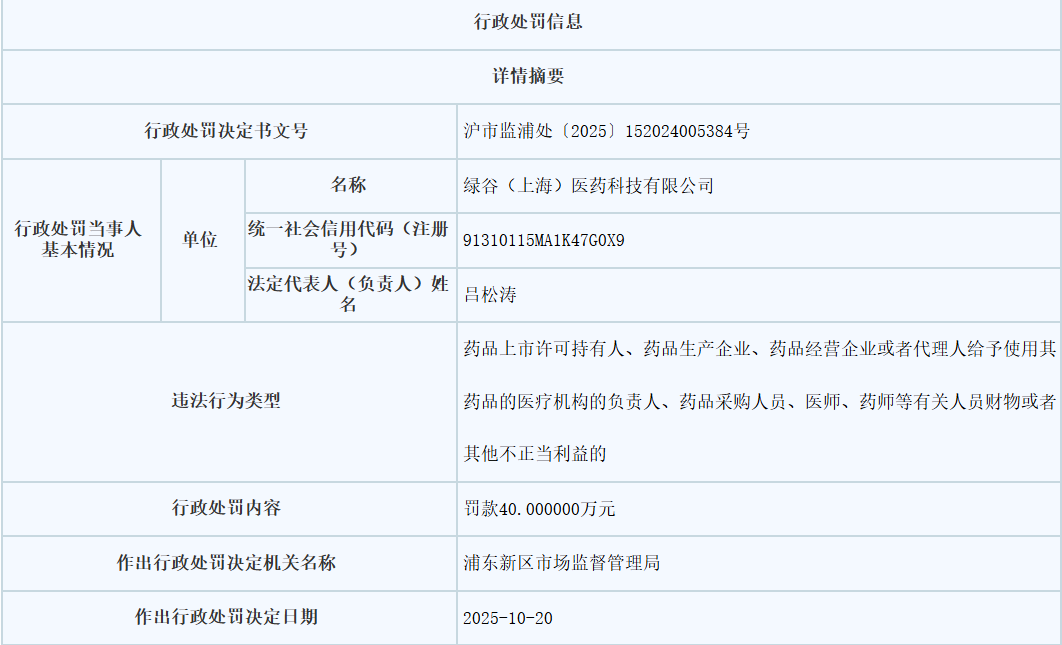
經核查,自2022年7月至2024年7月期間,綠谷醫藥違規開展學術會議共計587場,涉及講課費60.98萬元和餐飲費用約22.36萬元。
不過,監管部門未認定綠谷醫藥的違法所得,且考慮這是其首次違法,決定從輕處罰。
據了解,綠谷醫藥已于2025年10月24日繳清這筆罰款。
03
備受爭議的國產阿爾茨海默病”神藥”
甘露特鈉膠囊的命運,決定了綠谷醫藥的核心價值,也直接影響復星醫藥此次投資的成敗。
該藥是我國自主研發、全球首個“靶向腦-腸軸”機制的阿爾茨海默病治療新藥。
其研發始于1997年,凝聚了中國科學院上海藥物研究所耿美玉研究員團隊及相關機構二十余年的科研積累。
2019年甘露特鈉膠囊的有條件批準上市,一度被視為國產創新藥的重要突破。
它還填補了該疾病領域全球17年無新藥上市的空白,因此一度被視為國產阿爾茨海默病”神藥”。
但“有條件”三字,也意味著必須用更高標準的上市后藥品臨床證據加以驗證。
圍繞其療效,學界始終存在分歧。
2021年3月,國際期刊《阿爾茨海默病研究與治療》發布了甘露特鈉膠囊中國境內III期臨床試驗結果,入組818例患者。
結果顯示,該藥品對輕中度阿爾茨海默病患者的認知功能有明確的改善作用,尤其對中度患者效果更明顯。
不過,有觀點認為,該III期臨床試驗僅持續36周,未能充分反映藥物對阿爾茨海默病這一慢性疾病的長效作用。
同時,2022年5月甘露特鈉膠囊國際多中心Ⅲ期臨床試驗的提前終止,更加重了外界對該藥的疑問。
在監管層面,再注冊進程并不順利。
綠谷醫藥自2024年5月起遞交再注冊材料,2024年10月被要求補充資料。
今年8月,國家藥監局網站披露了藥品通知件送達信息。
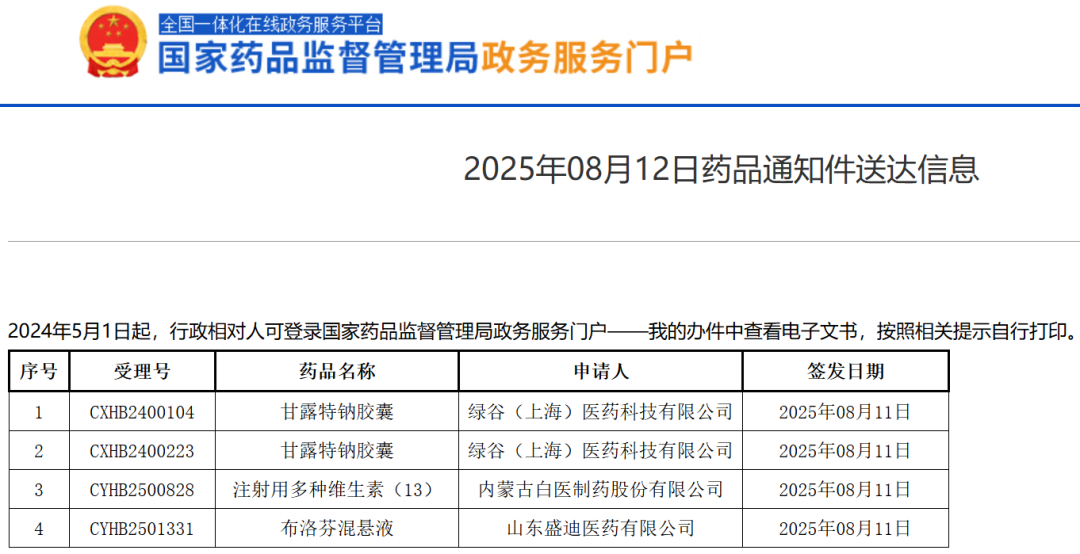
該信息顯示,甘露特鈉膠囊再注冊申請未獲批準,具體原因未對外公開。
有醫藥行業數據庫顯示,該藥的審評狀態為“已審評”,審評狀態為企業撤回/暫未批準等。
據媒體報道,行業人士分析,在審核甘露特鈉膠囊再申請注冊時,藥監局以安全有效為原則。
因此,對于甘露特鈉膠囊這樣的“first-in-class”新藥,監管部門就比較謹慎,希望企業能夠提供更多支持材料,比如藥物作用時間更長、樣本更多等。
企業之外,甘露特鈉膠囊停產引發的社會反響同樣不容忽視。
據人民日報健康客戶端此前報道,截至2025年6月6日,綠谷醫藥公司熱線和線上平臺已收到超過9300條患者求藥訴求,另有1200多名醫生建議盡快恢復甘露特鈉膠囊的供應。
企業此前披露數據顯示,自上市以來,甘露特鈉膠囊累計惠及超50萬名患者。今年6月爆發斷供風波后,有的電商平臺上該藥價格漲到了800元以上。
近兩年,侖卡奈單抗注射液(商品名:樂意保/Leqembi)、多奈單抗注射液(商品名:記能達)等國際創新藥相繼在華上市。
這些藥物上市后,我國上千萬阿爾茨海默病患者在決定治療方案時有了更多選擇。
而甘露特鈉膠囊需要面對的,除了更激烈的競爭環境,還有不確定的再審批注冊以及醫保準入。
04
結語
復星醫藥出手收購綠谷醫藥,本質是一場圍繞高風險創新藥的長期賭局。
停產裁員與再注冊受挫,以及最新的監管函件,揭示了交易所面臨的現實挑戰。
而未竟的臨床試驗與巨大的患者需求,也保留了不確定的想象空間。
交易能否真正落地,仍取決于監管審批與藥物臨床數據。
有了復星醫藥的支持,綠谷醫藥能否早日完成正在進行中的甘露特鈉膠囊上市后確證性臨床試驗,以盡快獲批再注冊,值得關注。


