12月16日-12月18日三天,國家藥監局連續發力否決了118個不同規格的藥品上市申請,無一例外都是仿制藥。此前,我國仿制藥的一致性評價審評十分溫和,缺資料企業在4個月內補審就行,一下子拒批如此多仿制藥,十分罕見。
文末有表格名單領取方式
據健識局粗略統計,118個品種共涉及86家企業,不乏京新藥業、福元藥業、白云山、普利藥業、葫蘆娃藥業等國內知名企業。上榜品種有已經集采多輪的產品,也有未集采品種,其中不乏一些超10億元規模的大品種,如苯磺酸左氨氯地平片、恩格列凈片、達格列凈片。
有一些品種是多家企業一起申報、一起被否。比如用于治療過敏鼻炎的比拉斯汀口服溶液,朗諾制藥、貝美藥業、凱潤藥業、西藏奧斯必秀醫藥4家企業申報,此次一并拒絕上市。
國家藥監局并未公開披露這些品種被否的原因,也沒有披露審評周期,無法判斷是近期集中否決還是清理“陳年積案”。業界驚呼:自2015年“7·22臨床數據核查風暴”后,很少見到藥監局這樣大刀闊斧了。
今年國家醫保局曾多次提及集采“反內卷”,遏制企業在國采中惡性低價競爭,希望高品質集采藥占領市場。國家藥監局此次否決上百個仿制藥,倒像是從源頭上“反內卷”,可能意味著今后我國仿制藥審評理念發生了根本性轉變。

仿制藥可被“一票否決”
第十批集采中,間苯三酚注射液共有36家企業申報,價格被壓到幾毛錢。當時就有媒體報道過:四川海夢智森最低報價與行業默認的注射劑包裝成本價相近,被認為是“不賺錢的自殺價”。
盡管第十批集采之前,國家醫保局籌劃了精密的集采方案,旨在防止內卷式報價,業界的習慣卻一時難以改變。
醫保和藥監部門只能從別的角度入手,治理不合理報價的行為。在報價后的常規檢查中,四川海夢智森公司因未能對受托生產企業的生產過程進行有效監控,受托生產企業四川太極部分批次產品關鍵生產過程出現偏差,被國家醫保局取消了中選資格,并列入違規名單。

國家已經注意到可以從批準角度約束扎堆現象。去年9月25日,國家藥監局藥品審評中心就曾發布《仿制藥質量和療效一致性評價受理審查指南(征求意見稿)》,明確指出自第一家品種通過一致性評價后,三年后不再受理其他藥品生產企業相同品種的一致性評價申請。
有公開數據表明,今年仿制藥一致性過評駁回數量一路上漲。有公開數據表明,今年1月,月度駁回通知件28個,這個數字到11月已漲到57個。
就在12月3日,CDE同時發布了兩份征求意見稿,首次系統性地明確了可直接導致注冊申請被駁回而不予發補的“重大缺陷”清單,從“可補正”轉向對觸及紅線問題的“一票否決”,再次縮緊了上市規則。
此次公布的被拒名單,明顯是為明年的集采“反內卷”打個前站。

非集采藥也反內卷
集采本來是治理仿制藥過多、品質過差的手段,但沒想到一些企業依然盲目上馬。此次拒批名單中,就有“大流量”競爭激烈的品種,比如批文數近900個的左氧氟沙星片,此次科泓藥業、狀元制藥、康林醫藥所申報產品就被卡在監管門外。
這些品種市場充分競爭,賽道早就擁擠不堪。通過控制審評來調整,不僅能在短時間內解決扎堆現象,還能保護這些已經競爭充分的品種,再對接續集采的價格進行控制。
值得注意的是,即使在競爭充分的品種里,藥企也想到了奪取市場的新辦法。近年來,不少企業打著創新的旗號,通過新劑型“試水”,國家藥監局也都看在眼里。一些新劑型并沒有改變真正意義上的治療格局,只是當年鄭筱萸時代“新藥大爆發”的翻版。
以苯磺酸氨氯地平為例,據健識局粗略統計,境內已有仿制生產批文的企業就多達203家,涉及片劑、分散片、膠囊、復合劑等劑型。此次被拒名單中,就有10款不同規格的苯磺酸氨氯地平片、苯磺酸氨氯地平顆粒、苯磺酸氨氯地平口服溶液,來自千金湘江藥業、肽渡生物等4家企業,只能算是通過改變劑型做出的改良版仿制藥。
還有治療蕁麻疹的比拉斯汀口服溶液,是市面上已有的比拉斯汀片的改良劑型,本質上并未提升治療效果,此次朗諾制藥、貝美藥業、凱潤藥業、西藏奧斯必秀醫藥4家的產品被否。
另外,有“膏藥大王”美譽的九典制藥,此次其吲哚美辛凝膠貼膏的首仿申請也意外折戟;布瑞哌唑口崩片、苯磺酸氨氯地平口服溶液、利多卡因噴霧劑等首仿上市申請也被拒。
此次上市失敗之后,企業再想通過類似方式占領市場也不太容易了。
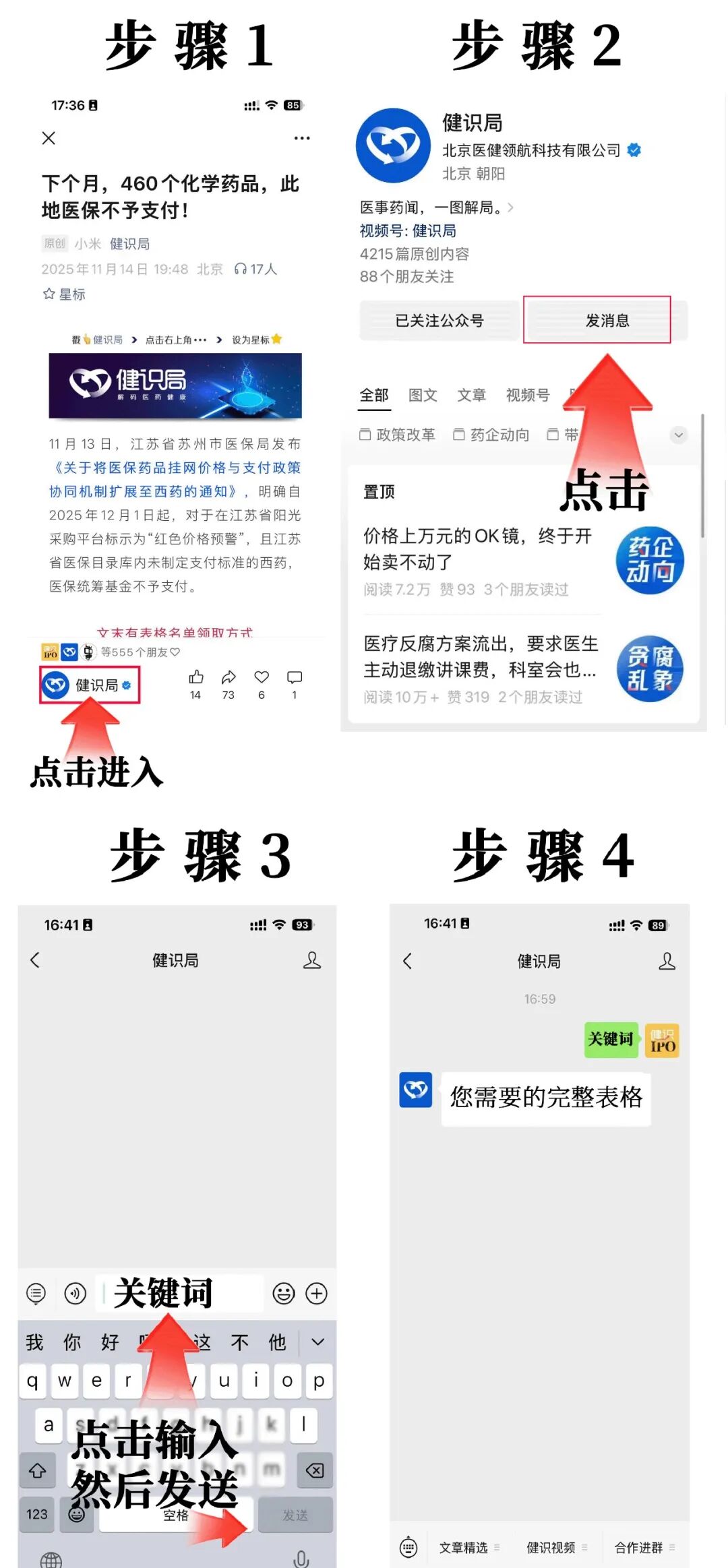
公眾號對話框發送“6”,即可領取“12月16-18日藥品通知件送達信息”
撰稿丨苗苗
編輯丨江蕓 賈亭
運營|李木子
插圖|視覺中國
聲明:健識局原創內容,未經許可請勿轉載


