多年以后,得知自己曾入選《自然》雜志“2025年影響科學(xué)進(jìn)展的十大人物”榜單,KJ·馬爾杜恩(KJ Muldoon)不會(huì)記得在他身上發(fā)生過的一切。
這名幾個(gè)月前才滿一歲的男嬰,一出生就被診斷患有致命的遺傳病。為了治病,他也成了已知首位接受個(gè)性化CRISPR基因編輯療法的患者。

接受基因編輯治療的嬰兒與研究團(tuán)隊(duì)成員。圖片來源:費(fèi)城兒童醫(yī)院
命在旦夕
2024年8月,KJ出生了。KJ的母親先前已經(jīng)生育了三個(gè)健康的孩子,因此在KJ誕生后,很快發(fā)現(xiàn)了他的異常。與其他剛出生就鬧個(gè)不停的新生兒不同,KJ出現(xiàn)了嗜睡和呼吸困難等癥狀,一來到人世就被迫做了大量檢查。檢查也很快發(fā)現(xiàn)了問題所在——KJ的血氨水平是正常范圍上限的 30 倍。
對人體而言,氨是一種有毒物質(zhì),通常來自蛋白質(zhì)的分解。血氨水平飆升,則意味著蛋白質(zhì)代謝出了問題。進(jìn)一步分析發(fā)現(xiàn),他血液中的氨基酸組成很不尋常,有些氨基酸水平極高,有些氨基酸則檢測不到,這進(jìn)一步縮小了疾病的范圍。
醫(yī)生們推斷KJ患有碳酰磷酸合成酶1(CPS1)缺乏癥,這種疾病會(huì)削弱人體分解蛋白質(zhì)的能力。基因測序證實(shí)了他們的判斷:KJ的父母各有一條CPS1基因帶有致病的變異,而這兩條基因又不巧都遺傳給了KJ,導(dǎo)致他的肝臟無法生成正常的CPS1酶,最終導(dǎo)致發(fā)病。
以當(dāng)時(shí)的治療標(biāo)準(zhǔn),CPS1無藥可治。醫(yī)生們能做的,只是先用透析清除KJ體內(nèi)過多的血氨,然后通過飲食對疾病進(jìn)行控制——限制蛋白質(zhì)的攝入,補(bǔ)充缺少的氨基酸,并通過一些藥物清除血氨。KJ的病情一度得到了控制,隨即生化指標(biāo)再次惡化。由于高氨血癥發(fā)作伴有永久性神經(jīng)損傷甚至死亡風(fēng)險(xiǎn),他在5個(gè)月大的時(shí)候,就被列入了肝臟移植候補(bǔ)名單。
但醫(yī)生們知道,KJ獲救的機(jī)會(huì)渺茫。CPS1缺乏癥在嬰兒早期的死亡率可高達(dá) 50%。先不說 KJ能否等到適合的肝臟,即便肝臟到位,在身體長到足以接受移植手術(shù)之前,他的神經(jīng)可能已經(jīng)發(fā)生了不可逆的損傷。
KJ的主治醫(yī)生之一、賓夕法尼亞州費(fèi)城兒童醫(yī)院的麗貝卡·阿倫斯-尼克拉斯(Rebecca Ahrens-Nicklas)決定用其他的方法來進(jìn)行治療。她的選擇是與賓夕法尼亞大學(xué)佩雷爾曼醫(yī)學(xué)院的基蘭·穆蘇努魯(Kiran Musunuru)教授合作,開發(fā)個(gè)性化的基因編輯療法。
基因魔剪
阿倫斯-尼克拉斯醫(yī)生和穆蘇努魯教授從2023年起就有一個(gè)設(shè)想,為那些罹患罕見病的患者量身定制基因編輯療法。
此前,兩人已有多年的研究與合作經(jīng)驗(yàn),并專攻蛋白質(zhì)的分解和循環(huán),KJ所患的病,恰好是他們的研究重點(diǎn)。也正是他們先前的工作,幫助醫(yī)生們第一時(shí)間鎖定了KJ體內(nèi)的致病變異。
為了治好KJ的病,他們選擇一種叫做“堿基編輯”(base editing)的工具,它本身是 CRISPR 基因編輯技術(shù)的衍生。
自誕生以來,CRISPR 基因編輯技術(shù)不僅改變了生物技術(shù)領(lǐng)域的基礎(chǔ)研究,更是已經(jīng)邁入臨床,造福病患。2023年,美國FDA批準(zhǔn)的Casgevy就是最先問世的基因編輯療法,用于“鐮狀細(xì)胞病”的治療。
“鐮狀細(xì)胞病”是一種遺傳疾病。由于基因變異,患者體內(nèi)的血紅蛋白結(jié)構(gòu)會(huì)發(fā)生微妙的變化。這些變異的蛋白質(zhì)則會(huì)進(jìn)一步影響紅細(xì)胞的形狀,往往使其從正常的“圓盤形”變?yōu)椤扮牭缎巍保摷膊∫惨虼说妹W冃魏蟮募t細(xì)胞極容易發(fā)生破裂,輕則造成患者貧血,重則可以危及生命。
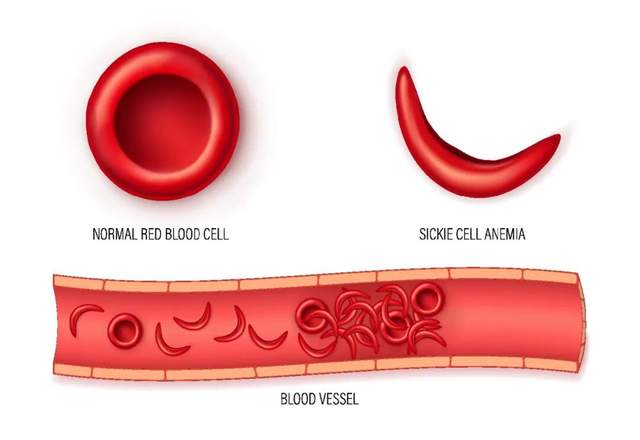
左:正常紅細(xì)胞;右:鐮狀紅細(xì)胞。圖庫版權(quán)圖片,轉(zhuǎn)載使用可能引發(fā)版權(quán)糾紛
基因編輯療法則可以從根源對疾病進(jìn)行治療。以采用CRISPR基因編輯技術(shù)的Casgevy為例,藥企會(huì)從符合條件的患者體內(nèi)提取出造血干細(xì)胞,對其進(jìn)行基因編輯,再將這些干細(xì)胞輸回到患者體內(nèi),讓紅細(xì)胞重新產(chǎn)生“不容易鐮變”的血紅蛋白,從根本上緩解疾病。經(jīng)過修正后,這些干細(xì)胞生成的紅細(xì)胞,可以合成正常的血紅蛋白,繼而解決患者的種種困擾。
和最初的CRISPR基因編輯技術(shù)相比,如今的“堿基編輯”技術(shù)更為精準(zhǔn)。如果基因組是一本生命天書,致病變異是其中的一個(gè)錯(cuò)別字,傳統(tǒng)的CRISPR基因編輯技術(shù)就是撕掉帶有錯(cuò)別字的一整頁內(nèi)容,再粘回一頁正確的內(nèi)容;而“堿基編輯”可以精準(zhǔn)地修正那一個(gè)錯(cuò)別字。
為此,利用“堿基編輯”可以開發(fā)出極為個(gè)性化的療法,堪稱是為患者量身定制。基于這個(gè)思路,研究人員們利用體外肝臟細(xì)胞模型(因 KJ 太小,無法從他體內(nèi)提取),測試了用“堿基編輯”修復(fù)基因變異的可行性,并選擇“脂質(zhì)納米顆粒”作為基因編輯療法的遞送工具。顧名思義,這種由脂質(zhì)組成的顆粒只有納米的尺寸。由于它本身會(huì)在肝臟聚集的特性,用于編輯肝臟細(xì)胞再適合不過了。
由于CRISPR基因編輯技術(shù)是一類相當(dāng)“模塊化”的技術(shù),業(yè)內(nèi)早有了一套標(biāo)準(zhǔn)的流程。這一系列的測試,也在KJ只有兩個(gè)月大的時(shí)候就已完成,節(jié)省了寶貴的時(shí)間。
在美國FDA完成初步審查后,研究人員快速完成了后續(xù)在動(dòng)物體內(nèi)的毒理測試,確認(rèn)了安全的初始臨床劑量,并評估了基因編輯的脫靶效應(yīng)(錯(cuò)誤編輯到不應(yīng)該編輯的基因位點(diǎn)),認(rèn)為安全可控。
一切就緒后,在患者6個(gè)月大時(shí),研究團(tuán)隊(duì)向FDA遞交了用于KJ一個(gè)人的臨床試驗(yàn)新藥申請,并于一周后獲準(zhǔn)開展治療。
立竿見影
2025年2月25日,KJ接受了第一次治療。為他量身定制的 CRISPR基因編輯療法,裝載在了納米脂質(zhì)顆粒中,順著靜脈輸注,進(jìn)入了他的血液循環(huán)。這些肉眼看不見的迷你“基因魔剪”在 KJ 小小的肝臟駐足,進(jìn)入肝臟細(xì)胞的細(xì)胞核,履行自己的使命——在人類基因組的30億個(gè)堿基對中,找到錯(cuò)誤的那一個(gè),進(jìn)行修正。
圖庫版權(quán)圖片,轉(zhuǎn)載使用可能引發(fā)版權(quán)糾紛
由于這款基因編輯療法只對KJ體內(nèi)的那個(gè)特定的變異生效,可以說,這是一款只為他一個(gè)人開發(fā)的個(gè)性化基因編輯藥物。正是因?yàn)檫@個(gè)里程碑意義,KJ才得以入選《自然》雜志今年的“影響科學(xué)進(jìn)展的十大人物”榜單。
為了確保基因編輯生效,醫(yī)生們理應(yīng)對 KJ 進(jìn)行測試,評估他體內(nèi)的CPS1酶活性是否有所回升,但他們沒有這么做,而是選用了一個(gè)更簡單的方法:在KJ的日常膳食中,添加更多的蛋白質(zhì)。
“在治療的10天后,我們就讓KJ攝入了更多蛋白質(zhì)。”阿倫斯-尼克拉斯醫(yī)生在費(fèi)城兒童醫(yī)院的一則介紹視頻中說到。
如果KJ的蛋白質(zhì)代謝能力依然存在缺陷,那么他體內(nèi)的血氨水平會(huì)重新上升,造成一系列癥狀,但醫(yī)生們并沒有觀察到這一現(xiàn)象。這也從側(cè)面說明,KJ的治療起效了。
盡管初步的結(jié)果看似積極,但KJ的生化指標(biāo)還是有著一些波動(dòng),有時(shí)會(huì)超出正常范圍,為此研究人員后續(xù)又進(jìn)行了兩次治療。治療后,KJ的血氨水平有著明顯降低,且可以保持全蛋白飲食。此外,用于降低血氨水平的藥物劑量也得到減半。這些結(jié)果再次表明,原本困擾KJ的疾病,或許已經(jīng)得到了根治。
其實(shí)不需要這些具體的數(shù)字,醫(yī)生們也能看到KJ正在逐漸變好。他的體重顯著增長,從第9百分位(體重僅高于 9%的同齡兒童),上升到了第26百分位。而且,他的神經(jīng)系統(tǒng)狀況也保持穩(wěn)定。
在醫(yī)院度過生命的前307天后,KJ 于今年6月第一次回到了自己的家,并繼續(xù)不斷成長。他開始能吃下固體食物,也正在練習(xí)邁出第一步。
“ KJ 仍需要在今后的一生中,密切接受健康監(jiān)測,但我們目前取得的初步結(jié)果非常令人鼓舞。”阿倫斯-尼克拉斯醫(yī)生在費(fèi)城兒童醫(yī)院的一則新聞里說道。
“我們希望每一位患者都有機(jī)會(huì)獲得與這位首例患者相同的治療效果,”穆蘇努魯教授補(bǔ)充道,“也希望其他學(xué)術(shù)研究者能借鑒這一方法,將其應(yīng)用于更多罕見疾病,為更多患者帶來擁有健康生活的希望。”
總結(jié):
基因編輯療法一度是科幻小說里的主角,如今已經(jīng)成為現(xiàn)實(shí)。隨著個(gè)性化基因編輯療法的誕生,未來這一領(lǐng)域勢必會(huì)有更為廣闊的發(fā)展,為那些罹患罕見疾病的孩子造福。
但另一方面,目前基因編輯療法昂貴的價(jià)格,也讓很多人望而卻步。如果有一項(xiàng)技術(shù)能救自己孩子的命,但它需要上百萬美元,這讓無力支付的父母如何是好?相比開發(fā)創(chuàng)新療法,這或許是個(gè)更難的問題。
參考文獻(xiàn)
[1]World's First Patient Treated with Personalized CRISPR Gene Editing Therapy at Children’s Hospital of Philadelphia,https://www.chop.edu/news/worlds-first-patient-treated-personalized-crispr-gene-editing-therapy-childrens-hospital
[2]Patient-Specific In Vivo Gene Editing to Treat a Rare Genetic Disease,https://www.nejm.org/doi/full/10.1056/NEJMoa2504747
[3]The baby whose life was saved by the first personalized CRISPR therapy,https://www.nature.com/articles/d41586-025-03847-2
[4]FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease,https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease
[5]A Breakthrough in Medicine: Personalized Gene Editing to Save KJ, https://www.youtube.com/watch?v=mUQWWLErLaY
策劃制作
作者丨葉拾 科普創(chuàng)作者
審核丨李旭 中國科學(xué)技術(shù)大學(xué)副教授、中國生物化學(xué)與分子生物學(xué)會(huì)會(huì)員
策劃丨徐來
責(zé)編丨張一諾
審校丨張林林


